Studie im Orginal: https://febs.onlinelibrary.wiley.com/doi/full/10.1002/2211-5463.70062
Copyright der deutschen Übersetzung bei tz-gesundheit
Zusammenfassung
Mitochondrien spielen eine zentrale Rolle bei der Energieproduktion in Zellen und der Regulierung von oxidativem Stress. Herkömmliche Methoden zur Bewertung von mitochondrialem ATP und reaktiven Sauerstoffspezies (ROS) basieren auf Metallproben, die das System unbeabsichtigt erden und somit die Ergebnisse verfälschen.
Um den Einfluss der Erdung auf die Mitochondrienfunktion zu untersuchen, haben wir fluoreszenzbasierte Experimente durchgeführt, um diese mitochondrialen Ergebnisse unter drei Bedingungen zu bewerten: verkabelt (geerdet), scheinbar geerdet und Kontrollgruppe.
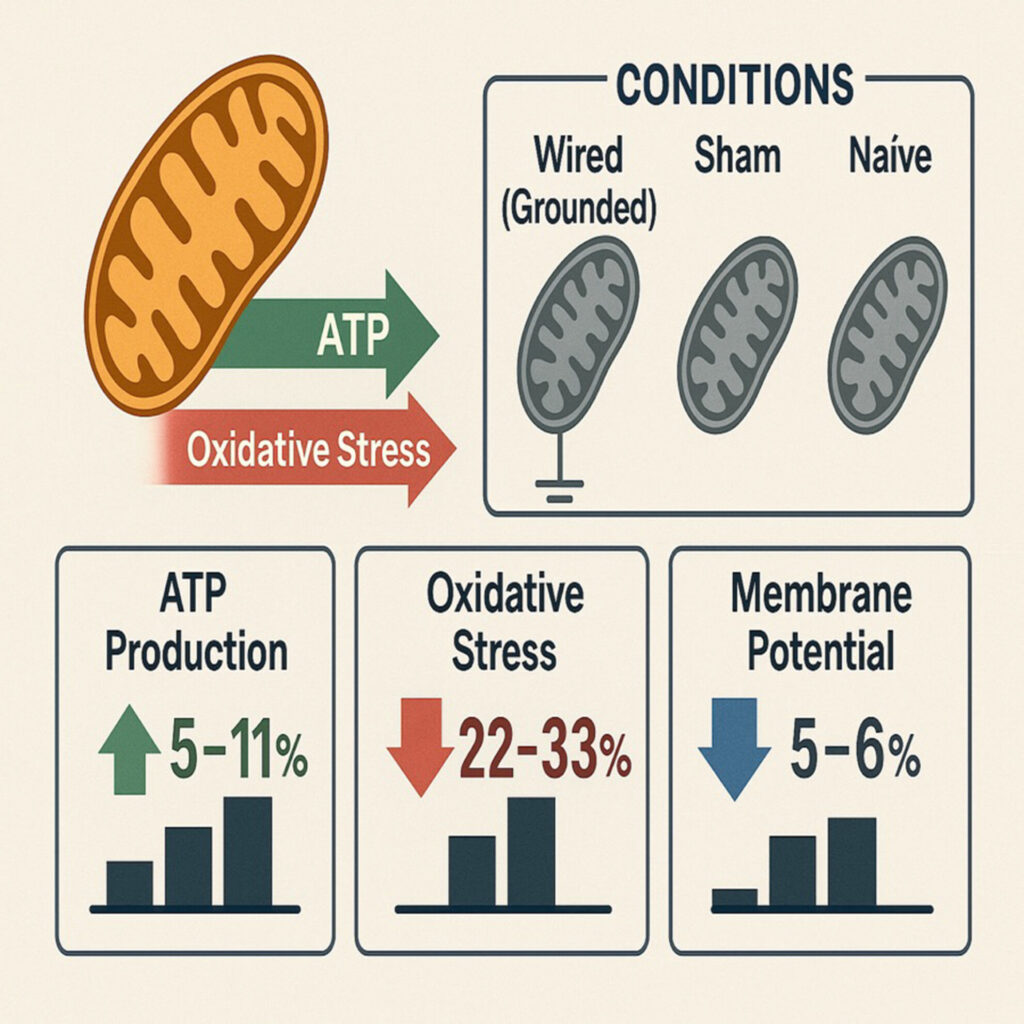
Mitochondrien unter geerdeten Bedingungen produzierten signifikant mehr ATP (um 5–11 %), reduzierten die ROS-Produktion (um 22–33 %) und verringerten das mitochondriale Membranpotenzial (um 5–6 %) als unter Schein- und Kontrollbedingungen.
Diese Ergebnisse deuten darauf hin, dass die Erdung die Bioenergetik der Mitochondrien durch Verringerung des oxidativen Stresses verbessert. Zukünftige Forschungen sollten die weiterreichenden Auswirkungen der Erdung auf die Gesundheit der Mitochondrien im Laufe der Zeit und ihre potenziellen therapeutischen Anwendungen untersuchen.
Abkürzungen:
ADP
Adenosindiphosphat
ANCOVA
Kovarianzanalyse (einseitige ANCOVA)
ANOVA
Varianzanalyse (einseitige ANOVA)
ARRIVE-Richtlinien
Tierforschung: Richtlinien zur Berichterstattung über In-vivo-Experimente
ATP
Adenosintriphosphat
DAMPs
schädigungsassoziierte molekulare Muster
ETC
Elektronentransportkette
FCCP
Carbonylcyanid-p-trifluormethoxyphenylhydrazon
HRP
Meerrettichperoxidase
MSHE-Puffer
Mannitol, Saccharose, EGTA, HEPES-Puffer
OCR
Sauerstoffverbrauchsrate
p-HPA
p-Hydroxyphenylessigsäure
RCR
Atemkontrollverhältnis
ROS
reaktive Sauerstoffspezies
Tukey’s HSD
Tukey’s ehrlich signifikanter Unterschied (Post-hoc-Test)
Mitochondrien werden zunehmend als wichtige Zentren für verschiedene kritische zelluläre Prozesse anerkannt, darunter der Energiestoffwechsel [[1–3]], die Immunantwort [[4–6]] und die Signalübertragung [[7–10]].
Diese Organellen sind für die Produktion von Adenosintriphosphat (ATP), dem primären Energieträger der Zellen, verantwortlich und regulieren außerdem die Produktion reaktiver Sauerstoffspezies (ROS), die maßgeblich zum oxidativen Stress beitragen [[3, 11–13]].
Eine Funktionsstörung dieser Prozesse steht im Zusammenhang mit der Entstehung zahlreicher chronischer und degenerativer Erkrankungen, die durch genetische, umweltbedingte und lebensstilbezogene Faktoren beeinflusst werden können [[11–14]].
Die ATP-Produktion in den Mitochondrien erfolgt über einen oxidativen Phosphorylierungsprozess, der in erster Linie auf der Elektronentransportkette (ETC) beruht. Dieser Prozess ist für die Erzeugung der für verschiedene Zellfunktionen benötigten Energie unerlässlich.
Während der oxidativen Phosphorylierung entstehen jedoch auch ROS als Nebenprodukt [[15, 16]]. Während geringe Mengen an ROS vorteilhaft sein können und eine wichtige Rolle in zellulären Signalwegen spielen, können übermäßige oder unkontrollierte ROS-Konzentrationen zu erheblichen Zellschäden und oxidativem Stress führen [[3, 11–14, 17–19]].
Ungleichgewichte in der ROS-Produktion werden zunehmend als wichtige Faktoren für die Entstehung verschiedener Gesundheitsprobleme anerkannt. Sie sind beispielsweise an der Alterung beteiligt und tragen zum altersbedingten Rückgang der Zellfunktionen bei [[1, 20–26]]. Darüber hinaus stehen erhöhte ROS-Spiegel in Zusammenhang mit einer Reihe von Stoffwechselstörungen, neurodegenerativen Erkrankungen wie Parkinson und Alzheimer sowie systemischen Erkrankungen wie Diabetes und bestimmten Krebsarten [[27]].
Neben ihrer Rolle bei der Energieproduktion und Signalübertragung haben Mitochondrien auch wichtige Funktionen im Immunsystem [[4, 5, 28–32]]. Unter Bedingungen einer Zellfunktionsstörung können Mitochondrien schädigungsassoziierte molekulare Muster (DAMPs) freisetzen, Moleküle, die das Immunsystem auf potenzielle Bedrohungen aufmerksam machen [[33]]. Diese Freisetzung von DAMPs kann Entzündungsreaktionen auslösen und spielt damit eine wichtige Rolle für die angeborene Immunität des Körpers [[33–39]].
Diese komplexen Wechselwirkungen unterstreichen, wie wichtig es ist, die Funktion der Mitochondrien zu untersuchen und zu verstehen, sowohl für die Prävention von Krankheiten als auch für die Entwicklung wirksamer Behandlungsstrategien.
Durch die gezielte Beeinflussung der Mitochondrienfunktion und die Regulierung des ROS-Spiegels könnte es möglich sein, das Fortschreiten verschiedener Krankheiten zu beeinflussen und die allgemeine Gesundheit zu verbessern.
Es ist von entscheidender Bedeutung zu verstehen, wie Mitochondrien unter verschiedenen Bedingungen ATP und ROS produzieren. Mitochondrien erzeugen ATP durch oxidative Phosphorylierung und produzieren dabei gleichzeitig ROS als Nebenprodukte. Diese reaktiven Moleküle können, wenn sie nicht streng reguliert werden, oxidativen Stress verursachen und so zu Alterung und Krankheiten beitragen. Grounding (oder Erdung) – der direkte Kontakt mit der Erdoberfläche – soll die Mitochondrienfunktion beeinflussen, indem er den Elektronenfluss beeinflusst und möglicherweise sowohl die ATP-Synthese als auch den ROS-Spiegel beeinflusst.
Interessanterweise werden viele experimentelle Verfahren, wie beispielsweise die Verwendung der Polarographie zur Messung des Sauerstoffverbrauchs mittels einer Clark-Sauerstoff-elektrode [[40, 41]], die erstmals von Chance und Williams [[42]] zur Untersuchung der Sauerstoffaufnahme und oxidativen Phosphorylierung in Mitochondrien eingesetzt wurde, unter geerdeten Bedingungen durchgeführt, um elektrische Störungen zu stabilisieren und die Signalerkennung zu verbessern.
Allerdings wurde bisher wenig Aufmerksamkeit darauf gelegt, wie Erdung die Bioenergetik der Mitochondrien verändern könnte. In unserer Studie haben wir die ATP- und ROS-Produktion sowie die Kopplung zwischen Elektronentransfer und ATP-Produktion in geerdeten und nicht geerdeten Mitochondrien verglichen, um zu untersuchen, ob die Erdung die Mitochondrien-funktion verändert.
Erdung oder Grounding bezeichnet den direkten Kontakt der Haut von Menschen oder Tieren mit der Erdoberfläche. Dies kann durch bloße Füße, Hände oder Erdungsvorrichtungen geschehen, die eine leitfähige Interaktion mit der Erdoberfläche ermöglichen. Der Kontakt mit der Erde neutralisiert übermäßigen oxidativen Stress und ROS und beeinflusst so die Physiologie des Körpers.
Es ist bemerkenswert, dass Menschen und alle anderen Tiere bis in die heutige Zeit, ins-besondere bis zur Einführung von isolierenden Schuhen mit synthetischen Sohlen in den 1950er Jahren, in ständigem direkten Kontakt mit dem Boden standen [[43]].
Earthing bietet zahlreiche Vorteile für das Wohlbefinden – wie durch klinische Studien und randomisierte klinische Studien belegt –, die darauf hindeuten, dass die Erdung von Personen ihre Stimmung sofort verbessert und Müdigkeit verringert [[44, 45]], den Vagustonus und die Herzfrequenzvariabilität verbessert [[44]], die Durchblutung und die Viskosität verbessert [[44, 46]], den Cortisolspiegel reguliert [[47]], senkt den Blutzuckerspiegel [[48]], fördert einen besseren Schlaf [[44, 47, 48]], mildert Entzündungen [[49]] und lindert verzögert auftretende Muskelkater oder Schmerzen im Allgemeinen [[44, 47, 49]] sowie zahlreiche weitere gesundheitliche Vorteile (https://earthinginstitute.net/research).
Die oben genannten Beobachtungen, einschließlich derjenigen über die Auswirkungen der Erdung auf die Verringerung von Muskelschäden [[50]] ohne Verbesserung des Energieverbrauchs beim Laufen oder der physiologischen Reaktionen von Spitzensportlern [[51]], veranlassten uns zu einer Untersuchung der Auswirkungen von ROS und ATP während der Erdung auf die Mitochondrien.
Unsere Ergebnisse zeigten, dass unter geerdeten Bedingungen die Mitochondrien weniger ROS produzierten als nicht geerdete Mitochondrien, was darauf hindeutet, dass Erdung dazu beitragen kann, oxidative Schäden an den Mitochondrien im Laufe der Zeit zu verhindern und damit oxidativen Stress zu minimieren.
Diese Ergebnisse unterstreichen die Bedeutung der Erdung für die Mitochondrienfunktion und zeigen, dass es notwendig ist, die Mitochondrienfunktion unter geerdeten und nicht geerdeten Bedingungen zu untersuchen, um ihren natürlichen bioenergetischen Zustand vollständig zu verstehen. Dieser Vergleich könnte neue Erkenntnisse über die potenziellen therapeutischen Vorteile oder Risiken der Erdung im Zusammenhang mit der Gesundheit der Mitochondrien und der Prävention von Krankheiten liefern.
Materialien und Methoden
Tiere
Männliche C57BL/6 (B6) Mäuse (Jackson Laboratories, Sacramento, CA, USA) wurden gemäß den Richtlinien des Institutional Animal Care and Use Committee (IACUC) der University of California, Davis, unter pathogenfreien Bedingungen gehalten. Die Institutional Review Board for the Protection of Animal Welfare (#21780) der University of California, Davis, genehmigte alle Versuchsverfahren und die Ethik dieser Studie. Die Studie wurde in Übereinstimmung mit den Anforderungen der IACUC und den ARRIVE-Richtlinien [[52]] durchgeführt. Die Mäuse erhielten ad libitum Futter und Wasser. Um die Mitochondrien aus der Leber zu isolieren, wurden die Mäuse durch CO2-Inhalation human getötet.
Isolierung der Mitochondrien und Bewertung der Bioenergetik
Alle Reagenzien waren von analytischer Qualität oder höher. Die Mitochondrien wurden aus den Lebern von 3 Monate alten männlichen Mäusen (Stamm C57BL/6) isoliert. Die Mitochondrien der Mäuseleber wurden wie zuvor beschrieben isoliert [[53–55]]. Kurz gesagt wurden die Proben in einem Isolationspuffer (0,22 m Mannitol, 0,07 m Saccharose, 1 mm EGTA, 10 mm HEPES, pH 7,4) mit einem handgeführten PRO Scientific Bio-Gen PRO200 Homogenisator im Verhältnis 1:10 (1 g Nassgewicht Gewebe in 10 ml Puffer) homogenisiert. Anschließend wurden durch differentielle Zentrifugation mit Mitochondrien angereicherte Fraktionen gewonnen. Gereinigte Mitochondrien aus den mit Mitochondrien angereicherten Fraktionen wurden durch differentielle Zentrifugation, gefolgt von einem Percoll-Gradienten und mehrfachen Waschungen in MSHE-Puffer (220 mM d-Mannitol, 70 mM Saccharose, 0,5 mM EGTA, 2 mM HEPES, 0,1 % fettsäurefreies Rinderserumalbumin, pH 7,4) und einer abschließenden Resuspension in 0,5 ml 150 mm KCl (endliche Proteinkonzentration von 70 mg·ml−1) gesammelt. Das Protein wurde mit dem Pierce™ BCA-Proteinassay-Kit gemäß den Anweisungen des Herstellers bestimmt. Der Sauerstoffverbrauch wurde mit einer Hansatech-Clark-Sauerstoffelektrode (Hansatech, King’s Lynn, Großbritannien) bewertet [[54–56]]. Mitochondrien (150–300 μg Protein) wurden in einen Puffer mit 0,22 m Saccharose, 50 mm KCl, 1 mm EDTA, 10 mm KH2PO4 und 10 mm HEPES, pH 7,4, in die Sauerstoffkammer gegeben. Die ATP-getriebenen Sauerstoffverbrauchsraten wurden in Gegenwart von (i) 1 mM Malat-10 mM Glutamat, gefolgt von 1 mM ADP und anschließend der Zugabe von 5 μM Rotenon und (ii) 10 mM Succinat, gefolgt von der Zugabe von 1 mM ADP und anschließend der Zugabe von 3,6 μM Antimycin A bewertet. Die Aktivitäten der NADH-gebundenen ATP-Produktion und der FADH2-gebundenen ATP-Produktion in den Mitochondrien wurden als Differenz der Sauerstoffaufnahme vor und nach Zugabe von Rotenon bzw. Antimycin A bewertet.
Erdungs-Versuchsaufbau
Neun ml MSHE-Puffer (0,21 m Mannitol, 0,07 m Saccharose, 1 mm EDTA, 1 mm EGTA, 10 mm HEPES, pH 7,4) wurden in 9 × 15 ml konische Kunststoffröhrchen aliquotiert, von denen 6 mit einem 14 cm langen Edelstahldraht (3 mm) verbunden waren (zur Hälfte in 1 ml Puffer eingetaucht) verbunden. Von den 9 konischen Röhrchen waren 3 geerdet (Edelstahldraht + Kabel mit dem Wasserhahn verbunden), 3 waren Scheinröhrchen (Edelstahldraht + Kabel nicht mit dem Wasserhahn verbunden) und 3 waren nicht geerdet oder Kontrollröhrchen (kein Edelstahldraht, kein Kabel mit der Erde verbunden; Abb. 1). Die Erdung wurde mit einem Handmultimeter überprüft. Ein digitales Multimeter (Commercial Electric MS83010A, manuell einstellbares digitales Multimeter) wurde auf Durchgangsprüfung mit akustischem Signal eingestellt, um die Integrität jedes Stromkreises zu überprüfen. Dieser Test stellte sicher, dass keine Unterbrechungen oder unbeabsichtigte Widerstände in den Stromwegen vorhanden waren. Das akustische Signal bestätigte in Echtzeit eine durchgehende Verbindung und ermöglichte so eine effiziente Fehlerbehebung. Darüber hinaus wurde mit dieser Methode überprüft, ob jede Röhre ordnungsgemäß geerdet war, um eine sichere und widerstandsarme Verbindung zur Erde zu gewährleisten, was sowohl für die Sicherheit als auch für die ordnungsgemäße Funktion der Schaltung von entscheidender Bedeutung ist.
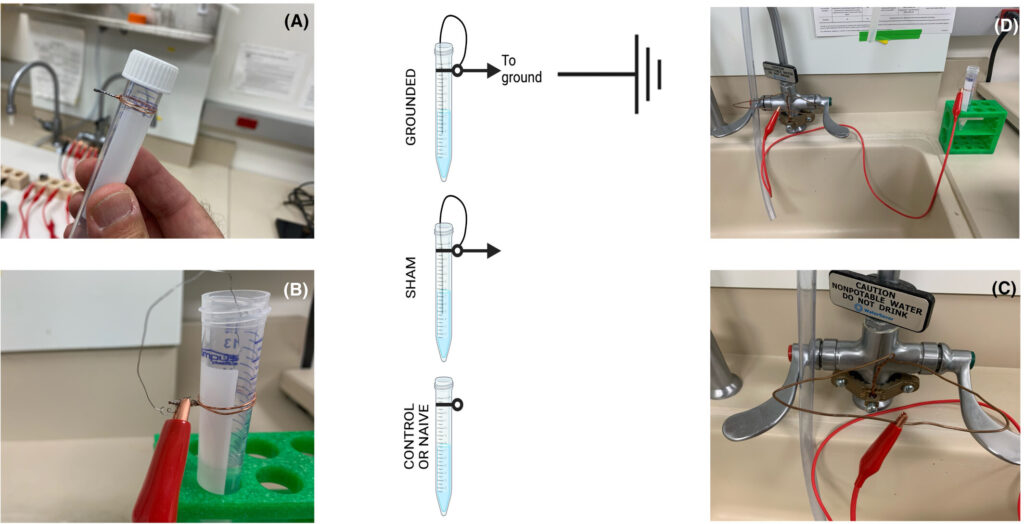
Abb. 1
Versuchsaufbau für Erdungsversuche. Gegen den Uhrzeigersinn: (A) Kupferdrähte wurden um konische 15-ml-Reagenzgläser gewickelt. (B) Ein Ende eines dünnen Edelstahldrahtes wurde mit dem Kupferdrahtbündel verbunden, während das andere Ende eine Schleife bildete, die in die Lösung im Reagenzglas eingetaucht war. Es wurde darauf geachtet, dass der dünne Draht die Reagenzglaswände nicht berührte. Ein separates rotes Kabel mit Metallkrokodilklemmen an beiden Enden verband den Kupferdraht (B) mit einem geerdeten Wasserhahn (C, D), was mit einem Multimeter überprüft wurde. Die Mitte der Abbildung zeigt eine schematische Darstellung der drei Versuchsaufbauten: geerdet (oben), scheinbar geerdet (Mitte) und Kontrollgruppe (unten). Der Pfeil symbolisiert das rote Kabel mit den Metallkrokodilklemmen.
Im gesamten Text werden mitochondriale Zustände erwähnt. Zur Verdeutlichung: In der mitochondrialen Atmung stehen Zustand 3, Zustand 3u und Zustand 4 für verschiedene Phasen der mitochondrialen Aktivität, die während der Respirometrie-Experimente beobachtet wurden. Zustand 3 (auch als aktive Atmung bezeichnet) spiegelt die maximale Rate des mitochondrialen Sauerstoffverbrauchs wider, wenn ADP für die Phosphorylierung verfügbar ist. In diesem Zustand wandeln die Mitochondrien durch oxidative Phosphorylierung aktiv Sauerstoff in ATP um, was ihre Energieproduktionskapazität darstellt. Zustand 3u (gekoppelter Zustand 3) tritt auf, wenn Entkoppler wie FCCP eingeführt werden, die den Protonengradienten über die innere Mitochondrienmembran abbauen. Dies führt dazu, dass die Mitochondrien Sauerstoff mit hoher Rate verbrauchen, ohne ATP zu synthetisieren, da die Elektronentransportkette weiter funktioniert, die ATP-Produktion jedoch von der Atmung entkoppelt ist. Der Zustand 4 (Ruhend) ist durch einen geringeren Sauerstoffverbrauch gekennzeichnet, nachdem das in Zustand 3 produzierte ATP verbraucht ist. In diesem Zustand steht kein ADP zur Verfügung, und die Atmung beschränkt sich auf den basalen Sauerstoffverbrauch, der zur Aufrechterhaltung des mitochondrialen Membranpotentials und zur Ausführung grundlegender Zellfunktionen erforderlich ist, ohne dass aktiv ATP produziert wird. Diese Zustände sind entscheidend für die Beurteilung der Mitochondrienfunktion, einschließlich des respiratorischen Kontrollverhältnisses (Zustand 3/Zustand 4), das zur Beurteilung der Effizienz der Mitochondrien-Kopplung und der allgemeinen bioenergetischen Gesundheit beiträgt.
Die Inkubationspuffer waren für die drei Bedingungen wie folgt: (i) nicht phosphorylierende Mitochondrien (oder im Ruhezustand): MSHE +10 mm Succinat (zum Testen der endogenen Synthese von ATP mit endogenem ADP); (ii) phosphorylierende Mitochondrien: MSHE +10 mm Succinat +1 mm ADP (zum Testen der phosphorylierenden Aktivität durch Bereitstellung von Substrat und ADP); und (iii) entkoppelte Mitochondrien (d. h. Entkopplung des Elektronentransports von der ATP-Synthese): MSHE +10 mm Succinat +3,6 μm Antimycin A + 20 nm FCCP. Bei t = 0 min wurden den einzelnen Röhrchen Mitochondrien in einer Endkonzentration von 0,3 mg·ml−1 hinzugefügt, gründlich gemischt, zu Beginn (geschätzt auf <5 min) wurden Aliquots entnommen und anschließend 15 und 30 min bei 22 °C inkubiert. An diesen drei Zeitpunkten wurden Aliquots von 200 μL (60 μg Protein) und 5 μL (1,5 μg Protein) in 1,8 mL ROS-Assay-Puffer (0,1 m K2HPO4, 5 Einheiten/ml-1 Meerrettichperoxidase und 400 μm p-Hydroxyphenylessigsäure) und 45 μl Assay-Puffer (BioVision, proprietär) auf Eis. Die mitochondriale H2O2-Produktion wurde fluorimetrisch nach einer zuvor beschriebenen Methode bestimmt [[57]]. Kurz gesagt folgt die Reaktion zwischen Meerrettichperoxidase (HRP), p-Hydroxyphenylessigsäure (p-HPA) und Wasserstoffperoxid (H2O2) einem peroxidase-katalysierten Oxidationsprozess, der zur Bildung eines fluoreszierenden Produkts führt. HRP nutzt H2O2 als Oxidationsmittel und bildet einen aktivierten HRP-Peroxid-Komplex, der Elektronen auf geeignete Substrate übertragen kann. In diesem Fall wird p-HPA durch den HRP-Peroxid-Komplex einer Ein-Elektronen-Oxidation unterzogen, wobei oxidiertes p-HPA entsteht, das anschließend dimerisiert oder zu einem stark fluoreszierenden Produkt polymerisiert. Das oxidierte p-HPA-Produkt zeigt eine starke Fluoreszenz, die spektrophotometrisch gemessen werden kann (typischerweise mit einer Anregung bei etwa 320–350 nm und einer Emission bei etwa 400–450 nm). Die Reaktion verläuft über einen radikalischen Mechanismus und wird häufig zum Nachweis von H2O2 in biologischen und enzymatischen Assays verwendet. Die Fluoreszenzintensität des oxidierten p-HPA-Produkts korreliert mit der Menge des vorhandenen H2O2, was einen empfindlichen Nachweis ermöglicht [[58]]. Am Ende des Experiments wurden zur ROS-Messung [[59]] 200 μl Probe – in dreifacher Ausfertigung – aus dem 2-ml-Reaktionsröhrchen in eine Vertiefung einer 96-Well-Platte gegeben und die Fluoreszenz nach 30-minütiger Inkubation bei 37 °C aufgezeichnet (Anregungs- und Emissionswellenlängen bei 315 bzw. 410 nm). Die ROS-Produktion wurde anhand einer Kalibrierungskurve berechnet, die mit einer Stammlösung von 100 μm H2O2 in Konzentrationen von 0–3 μm erstellt wurde. Negative (nur MSHE-Puffer) und positive (0,5 μm H2O2) Kontrollen wurden ebenfalls dreifach auf die Mikroplatte gegeben.
Am Ende des Experiments wurden die ATP-Konzentrationen nach 30-minütiger Inkubation bei 25 °C spektrophotometrisch (570 nm) mit einem BioVision-Kit (Kat.-Nr. K354) gemäß den Anweisungen des Herstellers bewertet. Zur Quantifizierung des ATP wurde eine Kalibrierungskurve von 0–10 nmol·Well−1 verwendet. Negative (nur MSHE-Puffer) und positive (5 nmol ATP/Well) Kontrollen wurden dreifach durchgeführt.
Das mitochondriale Transmembranpotenzial (Δψ) wurde fluorometrisch (507 und 529 nm, Anregungs- und Emissionswellenlängen) unter Verwendung von (0,4 μm) Rhodamin 123 (Fisher Scientific) als Sonde in einem Infinite M200 (Tecan, Morrisville, NC) gemessen. Dieser Fluoreszenzfarbstoff wird zur Bestimmung von Δψ in isolierten Mitochondrien verwendet. Aufgrund seiner kationischen und lipophilen Eigenschaften reichert er sich selektiv in Reaktion auf das Membranpotential in den Mitochondrien an [[60]]. Die Fluoreszenz wurde in Aliquoten nach 0 und 30 Minuten (technische Triplikate und zwei biologische Replikate) bewertet. Als Positivkontrolle für ΔΨ = 0 wurde am Ende jeder Messung 3 μm FCCP hinzugefügt, um ΔΨ durch Eliminierung der Protonenmotive Kraft über die innere Mitochondrienmembran zusammenbrechen zu lassen. Das Potenzial wurde unter Berücksichtigung der Verteilung des Farbstoffs in den Mitochondrien im Vergleich zu den Medien ohne Mitochondrien anhand der Nernst-Gleichung berechnet. Der Farbstoff Rhodamin 123 wird als Sonde für das mitochondriale Membranpotenzial verwendet, da er gut charakterisiert ist, keinen Verlust der mitochondrialen Kopplung verursacht und in geringen Konzentrationen nicht toxisch ist [[61, 62]].
Statistische Analyse
Alle Experimente wurden in zwei biologischen Replikaten und drei technischen Triplikaten durchgeführt. Der einseitige ANOVA-Test (Varianzanalyse) wurde verwendet, um festzustellen, ob es statistisch signifikante Unterschiede zwischen drei oder mehr Versuchsbedingungen gab. In diesem Fall umfassten die Bedingungen phosphorylierende, nicht phosphorylierende, entkoppelte oder geerdete, Schein- und naive Gruppen. Der Test bewertete, ob sich die Mittel-werte einer abhängigen Variablen zwischen diesen Gruppen unterschieden. Im Anschluss an die ANOVA wurde eine Tukey-post-hoc-Analyse durchgeführt, um spezifische Gruppen-unterschiede zu identifizieren. Der Tukey-Test kontrolliert die familienweise Fehlerquote und ist besonders nützlich bei der Durchführung mehrerer Vergleiche, um sicherzustellen, dass signifikante Unterschiede zwischen Gruppenmittelwerten nicht auf zufällige Schwankungen zurückzuführen sind. Zusätzlich wurde eine lineare Regressionsanalyse durchgeführt, um Beziehungen zwischen Variablen zu untersuchen, wobei der Pearson-Korrelationskoeffizient verwendet wurde, um die Stärke und Richtung der linearen Beziehung zwischen zwei kontinuierlichen Variablen zu quantifizieren. Alle statistischen Analysen wurden mit der Software JMP Version 17.0 durchgeführt, einem weit verbreiteten statistischen Tool zur Datenvisualisierung und -analyse.
Ergebnisse
Qualitätskontrolle der Mitochondrienpräparation
Die Qualitätskontrolle der Mitochondrienpräparate aus Mäuseleber wurde vor der Durchführung der Experimente zur Bewertung des Einflusses der Erdung auf die ATP- und ROS-Produktion in den Mitochondrien bewertet. Alle Mitochondrienproben wiesen unter Verwendung einer Standard-Polarographieausrüstung einen Respirationskontrollverhältnis (RCR) von 12 ± 3 auf. Die Proben wurden innerhalb von 2 Stunden nach der Vorbereitung verwendet, und während dieses Zeitraums gab es keinen signifikanten Rückgang des RCR <9. Unter diesen Bedingungen betrugen die Sauerstoffaufnahmeraten mit Malat-Glutamat und Succinat unter phosphorylierenden Bedingungen 26 ± 3, 39 ± 4 nmol und 27 ± 3 nmol verbrauchtem O2 × (min × mg Mitochondrienprotein)−1. Die Sauerstoffverbrauchsrate unter nicht-phosphorylierenden Bedingungen (nur Succinat; Zustand 4) betrug 3,5 ± 0,5 nmol O2 × (min × mg mitochondriales Protein)−1. Die ROS-Produktionsrate in Zustand 4 betrug 0,60 ± 0,02 nmol H2O2 × (min × mg Protein)−1. Wenn die Rate unter Zustand 4 den Protonenleck und den Elektronenleck aus der inneren Mitochondrienmembran widerspiegelt, dann macht der Elektronenleck (Austritt von Elektronen während der gesamten Elektronentransportkette vor der Reduktion von Sauerstoff zu Wasser an Cytochrom c Oxidase, was zur Produktion von Superoxidanionen führt) einen geringen Anteil der gesamten Sauerstoffverbrauchsrate in Zustand 4 aus (Verhältnis 6:1), was mit anderen Studien übereinstimmt [[63]].
Validierung des Versuchsaufbaus und der Vorgehensweise
Alle Versuche wurden bei 22 °C durchgeführt, um eine unspezifische Aktivierung von Proteasen und Lipasen zu vermeiden, die die Integrität der Mitochondrien während des gesamten Versuchs (~30–60 min) beeinträchtigen könnte. Bei höheren Temperaturen sind möglicherweise größere Mengen an Protease-, Kinase-, Phosphatase- und Lipase-Inhibitoren erforderlich, um einen Abbau zu verhindern, was unerwartete und manchmal nachteilige Auswirkungen auf die Bioenergetik der Mitochondrien haben kann. Zusätzlich ist die Sauerstoffaufnahme bei 37 °C zwar insgesamt höher, aber die langsamere Sauerstoffverbrauchsrate bei 22 °C stellt sicher, dass die Mitochondrien (oder Zellen) während des Bewertungszeitraums keine Hypoxie oder Anoxie erfahren. Dies war entscheidend, da die Erdungsvorrichtung keine Echtzeitmessung der Sauerstoffkonzentration in den Reagenzgläsern ermöglichte. Die Temperatur hat bekanntermaßen einen Einfluss auf die Mitochondrienfunktion, einschließlich der ATP-gebundenen Sauerstoffverbrauchsraten (OCR). Wie von anderen gezeigt, stützen Arrhenius-Diagramme der OCR in Zustand 3 mit Succinat im Vergleich zu 1/T die Temperaturabhängigkeit der Mitochondrienaktivität (Abb. 1A). Diese Ergebnisse deuteten auf eine proportionale Abnahme der OCR bei niedrigeren Temperaturen hin, da die Komponenten der Elektronentransportkette langsamer wurden [[64]]. Darüber hinaus lag die aus diesem Diagramm berechnete Aktivierungsenergie (14,7 ± 0,4 cal·mol−1) innerhalb der veröffentlichten Werte für den Temperaturbereich von 17–30 °C (15,4 bis 16 cal·mol−1) [[64]], was unsere Ergebnisse bestätigt. Darüber hinaus wurde der Bereich von 20–25 °C in mitochondrialen Studien weit verbreitet verwendet, darunter auch in den bahnbrechenden Arbeiten von Chance in den 1950er- und 1960er-Jahren, in denen Experimente bei Temperaturen zwischen 4 und 25 °C durchgeführt wurden, wobei die meisten bei 25 °C stattfanden [[65–70]]. Die Entscheidung, bioenergetische Bewertungen bei 22 °C durchzuführen, bewahrt somit die Integrität der Mitochondrien, ermöglicht zuverlässige Atmungsmessungen, vermeidet unerwünschten, übermäßigen enzymatischen Abbau und verhindert hypoxische Bedingungen.
Wir haben Experimente unter Verwendung spektroskopischer Techniken (Fluoreszenz) zur Bewertung von ROS und ATP konzipiert, da die meisten Mitochondrienstudien Metallproben zur Messung dieser Parameter verwenden, die die Mitochondrienlösung verändern und somit die Experimente verfälschen können. Sowohl die ATP-Synthese als auch die H2O2-Produktion wurden zunächst unter Basisbedingungen gemessen, um Referenzwerte festzulegen. Dieser Schritt war entscheidend, um sicherzustellen, dass alle nachfolgenden Veränderungen der ATP- und ROS-Werte genau auf die Erdung und nicht auf Schwankungen in den Mitochondrien-präparaten zurückgeführt werden konnten. Zur Gewährleistung der Genauigkeit und Zuverlässigkeit der Messungen wurden detaillierte Protokolle zur Quantifizierung von ATP und H2O2 befolgt. Die Varianzanalyse zeigte einen Haupteffekt des mitochondrialen Zustands auf die ATP-Produktion [F(2, 23) = 1062,44, P < 0,0001, η2 = 0,989]. Wie erwartet war die ATP-Produktion in phosphorylierenden Mitochondrien am höchsten, wenn ein Substrat (Succinat) und ADP in nicht limitierenden Konzentrationen bereitgestellt wurden (Zustand 3; Mittelwert ± SD = 401 ± 35 nmol × (min × mg Mitochondrienprotein)−1 im Vergleich zu den Zuständen 4 oder 3u). Post-hoc-Analysen mit Tukey’s HSD zeigten, dass die ATP-Produktion im Zustand 3 höher war als im Zustand 4 (P < 0,0001) und im Zustand 3u (P < 0,0001; Abb. 1B). Umgekehrt war die ATP-Produktion unter Bedingungen mit endogenem (limitierendem) ADP (aber mit überschüssigem Succinat oder Zustand 4) oder unter entkoppelten Bedingungen mit Antimycin (Zustand 3u mit Antimycin) vernachlässigbar [19 ± 3 bzw. 18 ± 2 nmol × (min × mg mitochondriales Protein)−1] und statistisch nicht unterschiedlich (P = 0,996).
In Bezug auf die ROS-Produktion zeigte die Varianzanalyse einen Haupteffekt der mitochondrialen Zustände auf die H2O2-Produktionsrate [F(2,24) = 29,47, P < 0,0001, η2 = 0,711]. Die mitochondriale ROS-Produktion war unter Antimycin-supplementierten, ungekoppelten Bedingungen maximal (Zustand 3u mit Antimycin = 0,18 ± 0,02 nmol H2O2 × (min × mg Protein)−1 im Vergleich zu phosphorylierenden (0,10 ± 0,02) und nicht-phosphorylierenden (0,13 ± 0,02) Bedingungen (P < 0,0001 bzw. P = 0,0002; Abb. 1C)). Die ROS-Produktionsrate unter phosphorylierenden Bedingungen war ebenfalls unterschiedlich und niedriger als unter nicht-phosphorylierenden Bedingungen (P = 0,035; Abb. 1C).
Unter Berücksichtigung eines aktuellen P/O-Verhältnisses von 1,636 für Succinat (1,636 ATP-Moleküle werden pro Sauerstoffatom produziert, das während der Oxidation von Succinat zu Wasser reduziert wird) [[71–73]], betrug der Anteil des für die ROS-Produktion verwendeten Sauerstoffs unter nicht-phosphorylierenden Bedingungen 2,2 % und unter phosphorylierenden Bedingungen 0,08 %. In Übereinstimmung mit diesen Werten und gemäß der aktuellen Literatur wird ein sehr geringer Anteil des von Mitochondrien verbrauchten Sauerstoffs für die ROS-Produktion verwendet, der typischerweise auf 0,15 % bis 2 % des gesamten Sauerstoffverbrauchs geschätzt wird, wobei die meisten Studien ihn näher am unteren Ende dieses Bereichs bei etwa 0,1–0,2 % [[74]] für Mitochondrien im Zustand 3 ansetzen.
Die Werte dieser Ergebnisse zeigten, dass nicht nur die Mitochondrienpräparate, die für die geerdeten Verdrahtungseinstellungen verwendet werden sollten, die Qualitätskontrolle hinsichtlich Unversehrtheit und Kopplung bestanden, sondern auch die Versuchsaufbauten und -ansätze.
Erdungsexperimente
Für die Erdungsexperimente wurden Kupferdrähte um den Hals von konischen 15-ml-Reagenzgläsern gewickelt. Ein dünner Edelstahldraht, der mit der Kupferspirale verbunden war, hatte eine Schleife, die in die Lösung im Reagenzglas eingetaucht war, sodass er die Reagenzglaswände nicht berührte. Die Erdung wurde hergestellt, indem der Kupferdraht an einen Wasserhahn angeschlossen wurde. Das System war im geerdeten Zustand vollständig mit dem Wasserhahn verbunden, was durch ein Multimeter als ordnungsgemäß geerdet bestätigt wurde (siehe Methoden). Die Scheinbedingung replizierte diesen Aufbau, hatte jedoch keine Erdungsverbindung und diente als Kontrolle für mögliche Nicht-Erdungseffekte. Die Kontroll-gruppe umfasste keine externe Verkabelung oder Erdung und diente als Vergleichsbasis (Abb. 2).
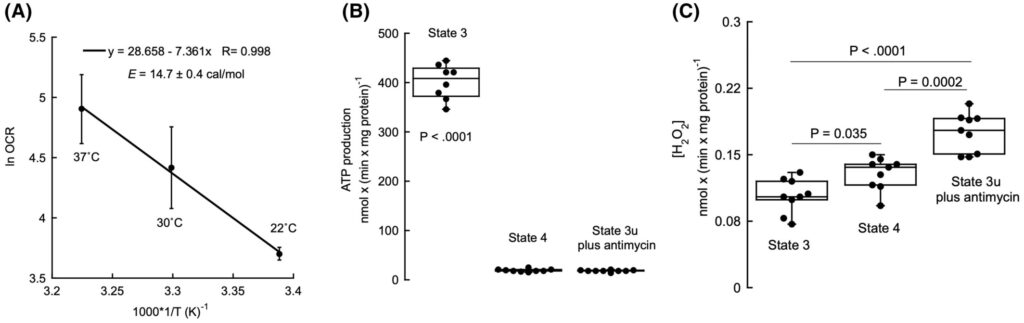
Abb.2
Arrhenius-Diagramm für Zustand 3 mit Succinat-, ATP- und Wasserstoffperoxidproduktion durch isolierte, gereinigte Mitochondrien aus Mäuseleber. (A) Die Sauerstoffverbrauchsrate (OCR) mit Succinat und ADP (Zustand 3) durch isolierte Mitochondrien aus Mäuseleber wurde bei drei Temperaturen bewertet. Das Arrhenius-Diagramm wurde anhand des natürlichen Logarithmus der mittleren OCR-Raten bei jeder getesteten Temperatur erstellt. Die Daten wurden an ein lineares Modell angepasst (Gleichung siehe Grafik; Pearson-Korrelation r(2) = −0,998; P = 0,036). Die Fehlerbalken stellen die Standardabweichung dar. Für die Grafiken B und C wurden isolierte Mitochondrien mit Succinat und ADP (phosphorylierend; Zustand 3), nur mit dem Substrat (Succinat) (nicht phosphorylierend; Zustand 4) und mit dem Entkoppler FCCP (Carbonylcyanid-p-trifluormethoxyphenylhydrazon) und Antimycin (entkoppelt; Zustand 3u mit Antimycin) inkubiert. Die ATP-Produktion (Panel B) und die Wasserstoffperoxid-produktion (Panel C) wurden in Aliquots (dreifach) nach 0, 15 und 30 Minuten bewertet, und die Raten wurden als Steigungen einer linearen Regressionsanpassung berechnet. Die statistischen Analysen wurden mit ANOVA (Varianzanalyse) gefolgt von Tukey’s Post-hoc-Test durchgeführt. Die Boxplots in den Feldern B und C sind so gestaltet, dass sie 50 % der Daten innerhalb jeder Box umfassen, wobei der Medianwert (definiert als der Datenwert, der in der Mitte zwischen dem kleinsten und dem größten Wert liegt) als Linie dargestellt wird. Die Ober- und Untergrenze der Box geben die Grenzen von ±25 % der variablen Population an. Die Linien, die sich von der Ober- und Untergrenze jeder Box erstrecken, stellen die Minimal- und Maximalwerte innerhalb des Datensatzes dar, die in einen akzeptablen Bereich fallen. Jeder Wert außerhalb dieses Bereichs, der als Ausreißer bezeichnet wird, wird als einzelner Punkt dargestellt (ein Ausreißer ist definiert als jeder Punkt, dessen Wert entweder größer als das obere Quartil +1,5 * Interquartilabstand oder kleiner als das untere Quartil − 1,5 * Interquartilabstand ist). Ausreißer werden in die Berechnungen für das Boxplot einbezogen. Alle Experimente wurden in mindestens zwei biologischen Replikaten und drei technischen Triplikaten durchgeführt.
Zunächst haben wir den zeitlichen Verlauf der H2O2-Produktion durch Mausleber-mitochondrien unter Zustand 4 und 3u mit Antimycin bewertet, um die lineare Reaktion innerhalb des Zeitfensters zu bewerten (Abb. 3A und Abb. 3B). Unter den drei Bedingungen waren die Reaktionen unter Zustand 4 linear mit Korrelationskoeffizienten > 0,93 [Pearson-Korrelation r(2) > 0,93, P < 0,001]. Ähnliche Ergebnisse wurden mit Zustand 3u und Antimycin erzielt. Eine einseitige Kovarianzanalyse (ANCOVA) ergab, dass die H2O2-Produktion unter geerdeten Bedingungen signifikant unterschiedlich und niedriger war als unter Schein- und Naivbedingungen für Zustand 4 (P = 0,023) und Zustand 3u mit Antimycin (P = 0,034).
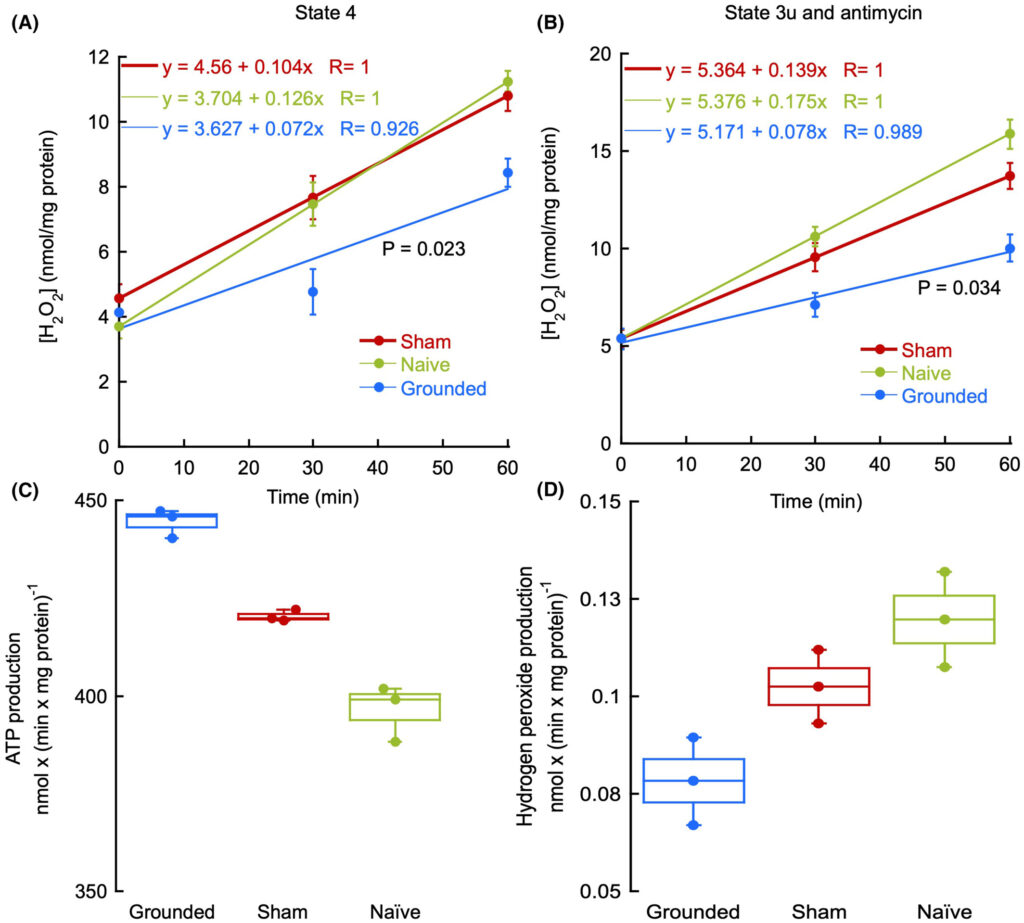
Abb. 3 A-D
Auswirkung der Erdung auf die ATP- und Wasserstoffperoxidproduktion sowie das Atemkontrollverhältnis in phosphorylierenden Mitochondrien. Die Wasserstoffperoxidproduktion wurde zu den angegebenen Zeitpunkten in Mitochondrien bewertet, die mit Succinat (A) und Succinat, FCCP und Antimycin (B) inkubiert wurden. Unter jeder Bedingung wurden Aliquots in dreifacher Ausfertigung entnommen: geerdet, Schein und naiv. Die linearen Regressionsgleichungen sind in jedem Feld dargestellt. Der P-Wert entspricht einer einseitigen ANCOVA (Kovarianzanalyse). Die Raten der ATP-Produktion (C) und der Wasserstoffperoxidproduktion (D) wurden in phosphorylierenden Mitochondrien (Zustand 3) bewertet. Die P-Werte wurden aus einer ANOVA-Analyse mit anschließender Tukey-Post-hoc-Analyse ermittelt. Alle Experimente wurden in zwei biologischen Replikaten und drei technischen Dreifachproben durchgeführt. In den Feldern A und B stellen die Fehlerbalken die Standardabweichungen dar. Die Boxplots in den Feldern C und D zeigen 50 % der Daten innerhalb jeder Box, wobei der Median durch eine Linie angezeigt wird. Die Boxgrenzen stellen ±25 % der variablen Population dar. Die Linien, die sich von den Boxen aus erstrecken, stellen die Minimal- und Maximalwerte innerhalb eines akzeptablen Bereichs dar. Werte außerhalb dieses Bereichs, sogenannte Ausreißer, werden als einzelne Punkte dargestellt (definiert als jeder Punkt, der größer als das obere Quartil +1,5 * Interquartilsabstand oder kleiner als das untere Quartil − 1,5 * Interquartilsabstand ist). Ausreißer werden in die Boxplot-Berechnungen einbezogen.
Die Raten der ATP-Produktion (Abb. 3C) und der H2O2-Produktion (Abb. 3D) wurden in Mitochondrien von Mäuseleber unter phosphorylierenden Bedingungen (Zustand 3) und unter den drei Einstellungen (geerdet, sham und naiv) bewertet. [Korrektur hinzugefügt am 24. Juli 2025 nach der ersten Online-Veröffentlichung: Dieser Satz wurde korrigiert.] Unter geerdeten Bedingungen wurden im Vergleich zu Schein- und Naivbedingungen signifikante Unterschiede beobachtet. Die Varianzanalyse zeigte einen Haupteffekt der Erdung auf die ATP-Produktion [F (2, 6) = 78,598, P < 0,0001, Pη2 = 0,963]. Post-hoc-Analysen mit Tukey’s HSD zeigten, dass die ATP-Produktion unter geerdeten Bedingungen 444 ± 2 nmol ATP × (min × mg Protein)−1 betrug und damit signifikant höher war als unter Scheinbedingungen (420 ± 1; P = 0,002) und unter Naivbedingungen (396 ± 7; P < 0,0001; Abb. 3C). In Übereinstimmung mit den Ergebnissen zur ATP-Produktion zeigte die Varianzanalyse einen Haupteffekt der Erdung auf die H2O2-Produktionsraten [F(2,6) = 10,803, P = 0,010, pη2 = 0,783]. Post-hoc-Analysen mit Tukey’s HSD zeigten, dass die ROS-Produktion zwischen Schein- und Naivbedingungen nicht unterschiedlich war [in nmol H2O2 × (min × mg Protein)−1 0,103 ± 0,009 und 0,12 ± 0,01; P = 0,213], aber beide waren höher als unter geerdeten Bedingungen (0,08 ± 0,01; P = 0,079 vs. Schein; P = 0,009 vs. naiv; Abb. 3D).
Zusammenfassend war die ATP-Produktion unter geerdeten Bedingungen am höchsten, begleitet von der niedrigsten mitochondrialen ROS-Produktion und der höchsten Kopplung der ATP-Produktion an die Sauerstoffaufnahme oder den Elektronenfluss durch die Elektronentransportkette.
In Anbetracht der Tatsache, dass die Erdung zu einem statistisch signifikanten Anstieg der ATP-Produktion im Vergleich zu Schein- und Naivbedingungen (5 bis 11 %) führte, jedoch mit einer stärkeren Auswirkung auf die ROS-Produktion (Rückgang um 22 bis 33 %) als unter Schein- und Naivbedingungen, und dass Forschungsstudien darauf hindeuten, dass bereits eine geringfügige Abnahme des Membranpotentials (<13 %) zu einer 1,2- bis 2-fachen Erhöhung der Atmungsrate und einer erheblichen (um 80 %) Verringerung der H2O2-Produktion führen kann, während die Auswirkungen auf die Atmung im Zustand 3 minimal sind [[75, 76]], haben wir das mitochondriale Membranpotential unter den drei Bedingungen bewertet. Der ΔΨ unter naiven oder Scheinbedingungen unterschied sich nicht (−174 ± 9 und −175 ± 10 mV), während er unter geerdeten Bedingungen signifikant niedriger war (−165 ± 8 mV). Alle drei ΔΨ fielen in Gegenwart von FCCP auf Werte von −20 ± 6 mV.
Diskussion
Die Ergebnisse unserer Studie unterstreichen den signifikanten Einfluss der Erdung auf die Mitochondrienfunktion, insbesondere auf die ROS-Bildung, die sich wiederum auf die Kopplung des Elektronentransfers an die ATP-Produktion auswirkt. Durch die Verwendung fluoreszenzbasierter Assays zur Bewertung dieser Parameter konnten wir die Störeffekte vermeiden, die bei herkömmlichen Metallsonden durch die Erdung der Mitochondrienlösung auftreten. Dieser methodische Ansatz ermöglichte es uns, den Einfluss der Erdung auf die Mitochondrien zu isolieren und genau zu bewerten. Derzeit gibt es keine experimentellen Arbeiten, die eindeutig belegen, dass Erdung die bioenergetischen Parameter der Mitochondrien verändert. Zwar gibt es verschiedene Behauptungen über die gesundheitlichen Vorteile der Erdung, darunter auch mögliche Auswirkungen auf oxidativen Stress, doch bleiben diese Behauptungen aufgrund fehlender direkter empirischer Belege weitgehend spekulativ. Unsere Studie zielte darauf ab, diese Wissenslücke zu schließen, indem wir experimentelle Daten zur Bewertung der Frage lieferten, ob Erdung messbare Auswirkungen auf die mitochondriale Atmung, das Membranpotenzial und oxidativen Stress hat. Anstatt einen kausalen Zusammenhang anzunehmen, haben wir systematisch getestet, ob Erdung unter kontrollierten Bedingungen einen bioenergetischen Einfluss ausübt. Damit wollten wir eine Grundlage für zukünftige Untersuchungen zur potenziellen physiologischen Relevanz der Erdung auf mitochondrialer Ebene schaffen.
Unsere Studie zeigte, dass Erdung zu einer leichten Abnahme des mitochondrialen Membranpotentials führte, was die Verringerung der ROS-Produktion und die Erhöhung der ATP-Produktion erklärt. Obwohl die Abnahme ~5–6 % betrug und als geringfügige biologische Auswirkung angesehen werden kann, muss berücksichtigt werden, dass die Protonenleckraten in den Mitochondrien von Säugetieren exponentiell mit ΔΨ ansteigen und dass die Erhöhung der Protonenleitfähigkeit über die mitochondriale Membran mit steigendem ΔΨ ebenfalls nicht ohmsch ist. Protonen- und Elektronenleck sind eng miteinander verbunden, da die Superoxidproduktion sehr empfindlich auf die Abnahme von ΔProton aufgrund von Protonenleck reagiert [[77]]. Unsere Ergebnisse stimmen mit denen anderer Forscher überein, die darauf hinweisen, dass bereits ein geringer Rückgang des Membranpotentials zu einer erheblichen Verringerung der H2O2-Produktion führen kann [[75, 76]]. Dies steht im Einklang mit unseren Erkenntnissen und stützt die Hypothese, dass elektrische Erdung die Bioenergetik der Mitochondrien durch subtile Veränderungen des Membranpotentials modulieren kann.
Die mitochondriale Atmung und das Membranpotential werden häufig in Atmungskammern gemessen, die mit Elektroden ausgestattet sind, wie beispielsweise den häufig verwendeten Oxygraph-Systemen. Diese Systeme stützen sich auf den Sauerstoffverbrauch als Indikator für die mitochondriale Aktivität. Allerdings berücksichtigen sie nicht immer mögliche Artefakte, die durch die Erdung der Mitochondrien entstehen – ein Phänomen, bei dem Mitochondrien physisch mit Oberflächen interagieren und dadurch ihr bioenergetisches Verhalten verändern können. Wenn Mitochondrien in Suspension vorliegen, wie dies in vielen hochauflösenden Respirometrie-Experimenten der Fall ist, können sie ihre natürlichen elektrochemischen Gradienten aufrechterhalten. Wenn Mitochondrien jedoch mit Kammeroberflächen wie den Elektroden eines Oxygraphen in Kontakt kommen, kann diese Erdung die Ladungsverteilung beeinflussen, was sich auf die Messung des Membranpotentials auswirkt und möglicherweise den Sauerstoffverbrauch verändert. In Systemen, in denen Mitochondrien auf Oberflächen abgelagert oder in Mikro-Kammern eingeschlossen sind, können Erdungseffekte zu einer Dissipation des Membranpotentials führen, was eine künstliche Depolarisation oder eine veränderte Protonenleckdynamik zur Folge hat. Dies könnte zu einer Unterschätzung der respiratorischen Kontrollverhältnisse oder zu einer Fehlinterpretation der mitochondrialen Kopplungseffizienz führen. Das Verständnis dieser möglichen Effekte ist entscheidend, um sicherzustellen, dass die gemessene Atmung und das gemessene Potenzial das physiologische Verhalten der Mitochondrien genau widerspiegeln. Der Vergleich von elektrodenbasierten O2-Verbrauchs-Messungen mit alternativen Ansätzen, wie fluorometrischen potentialempfindlichen Farbstoffen oder isolierten Vesikelsystemen, kann dazu beitragen, zu klären, wie die Erdung der Mitochondrien die bioenergetischen Bewertungen beeinflusst.
Reduzierte ROS-Spiegel sind vorteilhaft, da übermäßige ROS oxidativen Stress verursachen und Zellbestandteile wie Lipide, Proteine und DNA schädigen können. Diese Beobachtungen deuten darauf hin, dass Erdung die mitochondriale Bioenergetik positiv beeinflusst, indem sie oxidativen Stress durch eine verringerte ROS-Produktion reduziert. Somit könnte Erdung ein vielversprechendes therapeutisches Ziel für die Veränderung der Pathophysiologie sein, die mit der mitochondrialen Superoxidproduktion und Erkrankungen verbunden ist, die durch erhöhten oxidativen Stress aufgrund von mitochondrialer Dysfunktion gekennzeichnet sind.
Unsere Ergebnisse stützen die Hypothese, dass Erdung in verschiedenen Kontexten therapeutisches Potenzial bietet. Verringerte ROS-Spiegel reduzieren oxidative Schäden, was Prozesse verlangsamen kann, die mit Alterung und chronischen Krankheiten verbunden sind, die wiederum mit einer Abnahme der Mitochondrienfunktion einhergehen.
Zusammenfassend unterstreichen diese Ergebnisse die Bedeutung der Erdung in der Mitochondrienforschung und deuten auf potenzielle therapeutische Vorteile der Erdung für die Behandlung von Erkrankungen hin, die mit einer Funktionsstörung der Mitochondrien und oxidativem Stress zusammenhängen. Zukünftige Studien sollten die langfristigen Auswirkungen der Erdung und ihre möglichen Anwendungen in präventiven und klinischen Kontexten untersuchen.
Danksagung
Wir danken J. Dayton und S. Wykoff-Clary für ihre technische Unterstützung.
Interessenkonflikt
Alle Autoren haben finanzielle oder sonstige Interessen im Zusammenhang mit der eingereichten Arbeit offengelegt, die die Objektivität der Autoren beeinträchtigen oder den Inhalt des Artikels beeinflussen könnten. Keine finanziellen oder nichtfinanziellen Interessenkonflikte könnten die Objektivität, Integrität oder den Wert dieser Veröffentlichung beeinträchtigen, indem sie das Urteil und Handeln der Autoren bei der Darstellung, Analyse und Interpretation der Daten beeinflussen. C.G. ist Mitglied der Redaktion von Scientific Reports. Sie erhielt eine Vergütung als Field Chief Editor für Frontiers in Molecular Biosciences und Honorare für die Teilnahme an NIH-Peer-Review-Sitzungen.
